Investigation of Configurations of { \left[{\bf{UO}}_{\bf{2}}({\bf{OH}})_{\boldsymbol{m}}({\bf{H}}_{\bf{2}}{\bf{O}})_{\boldsymbol{n}}\right]^{{\bf{2}}-{\boldsymbol{m}}}} in Uranium Wastewater
-
摘要:
乏燃料含铀废水既是放射性污染物,也是可回收利用的铀资源。U(Ⅵ)在水溶液中的化学形态对其在环境中的迁移性和溶液的形态转化调控有重要意义。采用密度泛函理论方法计算研究铀酰离子与羟基和水形成配合物的结构和性质,求得优化几何构型、能量、形成过程和热力学性质。自发生成的6配位配合物中,羟基和水的配位数分别是4和2。直线型铀酰阳离子同羟基和水形成配合物,按Oyl-U-Oyl(Oyl表示酰基氧)角度不同,存在线型和“V”型两种构型。分子式相同时,铀酰基团的U-Oyl键长随着Oyl-U-Oyl角度的减小而增长。随着OH‒和H2O配体数增加,配合物的结构趋于笼状;当OH‒配体数为3或4时,倾向于生成“V”型铀酰配合物。逐级生成 [UO2(OH)m]2‒m配合物时,开始释放出大量的能量,但是随着OH‒配位数增加,释放的能量急剧减少,直至吸收能量。而逐级生成 [UO2(H2O)n]2+配合物时,则持续释放出少量能量;H2O配体数增加时有利于形成稳定配合物。生成[UO2(OH)m]2‒m (m<4)配合物的反应能自发进行;而生成[UO2(OH)4]2‒配合物的反应,仅线型[UO2(OH)3]‒生成“V”型[UO2(OH)4]2‒是自发过程。
Abstract:Uranium-containing wastewater from the spent nuclear fuel are radioactive wastes as well as energy sources. It is meaningful to investigate the configurations of aqueous U(Ⅵ) for its environmental migrations and configuration conversions. Herein the uranyl complexes of \left[\mathrm{UO}_2(\mathrm{OH})_m(\mathrm{H}_2\mathrm{O})_n^{ }\right]^{2-m} (m=1-4, n=1-2) were investigated by density functional theory at the PBE0 level, in combination with ECP80MWB_AVQZ + 2f basis set for uranium and 6-311+G** basis set for hydrogen and oxygen. The optimized geometries, energies, formation processes and thermodynamic properties of the complexes were predicted. In the six coordinated complexes that are spontaneously produced, the ligand numbers of OH‒ and H2O are 4 and 2, respectively. There exist either linear or “V” configurations, sorting by the angles of Oyl-U-Oyl, when a linear uranyl dication coordinated with H2O and hydroxyl. The “V” type complexes with Oyl-U-Oyl angle being about 40° are found only when the coordinated number of OH‒ is more than 2. The total energy of “V” type [UO2(OH)3]‒ is lower than that of its linear isomer by 131.46 kJ/mol at the MP2 level. The complexes with U-OH2 bond and “V” type Oyl-U-Oyl are the most stable. The complexes tend to have a “V” configuration when the coordinated hydroxyl number is 3 or 4. The lengths of U-Oyl bond increase as the angles of Oyl-U-Oyl decrease. The complexes tend to be cage-like as more hydroxyl and H2O are coordinated. When {\mathrm{UO}}_2^{2+} coordinates with OH‒ one by one, a large amount of energy is released initially. As the coordinated number increases, the released energy dramatically decreases or even changes to an energy adsorbing process. When {\mathrm{UO}}_2^{2+} coordinates with H2O one by one, the processes release a small amount of energy continuously. The increase of H2O ligand is beneficial to the stability of the complexes. The formations of [UO2(OH)m]2‒m (m<4) are spontaneous processes. However, for the formation of [UO2(OH)4]2‒, only the process of linear [UO2(OH)3]‒ converting to “V” type [UO2(OH)4]2‒ is spontaneous, indicating the complexes tend to form “V” configuration when the number of OH‒ is 4. The spontaneous pathways and energy changes in the stepwise coordination processes were speculated on the basis of energy analysis. The above characteristics of [UO2(OH)m(H2O)n]2‒m play an important role on the ion activity, solubility and ion exchange of uranyl in alkaline solutions. OH‒ and H2O compete with each other in coordinating, which influences the concentration and species distribution of [UO2(OH)m(H2O)n]2‒m configurations. The results herein provide theoretical basis for understanding and controlling the behaviors and reactions of uranyl aqueous solutions.
-
Keywords:
- spent nuclear fuel /
- uranium reprocessing /
- uranyl ion /
- density functional theory /
- thermodynamic
-
乏燃料后处理过程中会产生大量含铀废水,U(Ⅵ)在废水中主要以 {\mathrm{UO}}_2^{2+} 形态存在[1],具有重金属毒性、放射性、迁移性较强的特征。因此,从乏燃料中回收铀元素,不仅可以极大地减少其对环境的污染与破坏,而且可以充分提高核燃料和铀元素资源的利用率[2-4]。关于含铀废水处理,主要有沉淀法、膜过滤法、溶剂萃取法、离子交换法和吸附法等[5]。对于乏燃料中铀的回收,早先是在酸性介质中进行的,如使用硝酸、硫酸和磷酸等进行回收再处理。传统的回收工艺是采用磷酸三丁酯(tributyl phosphate, TBP)溶液及其惰性稀释剂如煤油、正己烷等从乏燃料中回收铀[6-8]。在这种回收过程中随着TBP的加入,原来的单层有机相分层为新的有机相和水相,并且在新的有机相中TBP与硝酸铀酰UO2(NO3)2/硝酸反应形成了加合物UO2(NO3)2(TBP)2[2,6,9-10]。为从UO2(NO3)2(TBP)2中进一步提取铀元素,需要进一步的对溶液进行处理。而通常处理所采用的是碱性溶液,如氢氧化钠或碳酸钠溶液等。在加入这些处理溶液后,其中的OH‒或者碳酸根离子会与中心铀酰基团({\mathrm{UO}}_2^{2+} )形成作用力更强的配位键,取代原配合物中的TBP配体和{\mathrm{NO}}_3^- 配体,使它们分别进入到有机相和水相中,并且在水相中形成新的配合物[2, 11]。研究水相中铀酰离子是如何进一步同羟基和水等介质中的离子或分子形成新的配合物对理解其形态及相互转化具有重要意义[12-13]。本工作拟运用密度泛函理论(DFT)模拟并研究铀酰基团同OH‒和H2O配体形成的配合物的结构以及热力学性质。
1. 计算方法
用DFT方法在PBE0水平下进行计算,文献[14]表明该方法适用于U(Ⅵ)化合物。铀原子选用含80个内核电子和准相对论效应的ECP80MWB_AVQZ+2f 基组,氢和氧原子用6-311+G**基组,其中的弥散基适用于带负电荷的氧原子,两类较大基组的组合可得到较高的计算精度。配合物的几何构型均为气相条件下的全优化,收敛阈值采用程序默认值。铀酰离子中铀的价态为Ⅵ,价电子数为零,其自旋多重度为1。优化构型的振动频率无负值,验证其结构为势能面上的极小点。所有量子化学计算均用Gaussian 09程序包[15]完成。键级的计算采用Multiwfn程序[16]。
2. 结果与讨论
2.1 羟基-铀酰配合物的优化几何构型
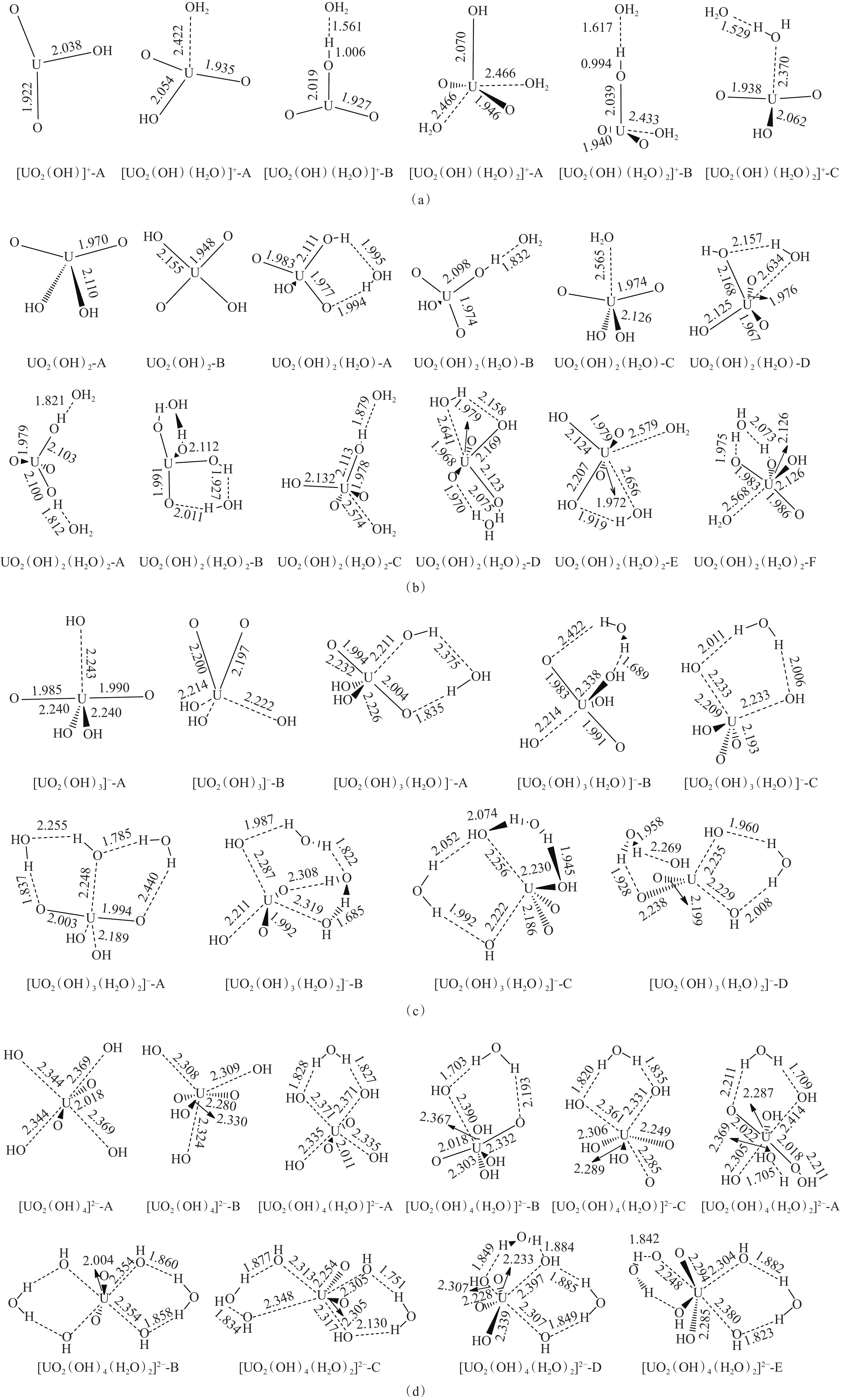
铀酰配合物的优化几何结构示于图1。由图1可知,OH‒配体与铀酰离子( {\mathrm{UO}}_2^{2+} )中的铀原子通过U-OH键作用相结合,形成了一系列羟基-铀酰[UO2(OH)m]2−m配合物。由于铀酰基团有两种不同的几何构型,也使得同一分子式的配合物有不同的分子结构。其中最普遍的是线型Oyl-U-Oyl结构(Oyl是铀酰基团中的氧原子),即两个氧原子位于铀原子的相对两侧。当m=1、2时,这种线型铀酰结构中的Oyl-U-Oyl角度为145º~160º;而m=3、4时,直线型Oyl-U-Oyl角度是170º~180º (小于180º),该结构仅存在于UO2(OH)2-B中。另一种是“V”型Oyl-U-Oyl结构的铀酰,Oyl-U-Oyl角度约为40˚,这种“V”型的铀酰结构只发现于OH‒配体数大于2的配合物中。文献[17]表明,线型结构与“V”型结构通过与水的质子协同交换可相互转化:即介质水的质子转移到线型铀酰氧原子上,与此同时,铀酰离子赤道平面上的羟基氢转移到水的羟基上,赤道上的U-OH生成U=O。比较铀酰配合物的几何结构发现,具有线型铀酰结构的配合物中的U-Oyl键键长比游离{\mathrm{UO}}_2^{2+} 中的U-Oyl键(1.887 Å,1 Å=0.1 nm)长0.04~0.20 Å,而“V”型铀酰结构的配合物中的U-Oyl键则增长了0.30~0.40 Å。此外,随着铀酰基团上OH‒配体数目的增加,[UO2(OH)m]2‒m配合物的结构不再是平面结构。例如,将OH‒配体作为一个整体单元来看,[UO2(OH)]+-A配合物是平面三角形,而再加入一个OH‒配体后则变成了四面体构型UO2(OH)2-A。随着更多配体的加入,配合物的几何结构开始趋于笼状结构。尤其是当m>2时,[UO2(OH)m]2‒m配合物全是多面体结构。由此可以看出,随着OH‒配体的增加,羟基-铀酰配合物变得更加多样和复杂。
为了进一步比较这些配合物结构的区别,计算得到[UO2(OH)m]2‒m配合物中的U-Oyl键和U-OH键的键级,结果列入表1。由表1可知:[UO2(OH)m]2‒m同分异构体中的U-Oyl键的键级随Oyl-U-Oyl角度的增加而增大,而U-OH键的键级随Oyl-U-Oyl角度的增加而减小;比较U-OH和U-Oyl键的键级变化,可以发现在相同的角度变化条件下,前者的键级变化比后者的要小。另一方面,随着OH‒配体的增加,U-Oyl键和U-OH键的键级都在减小。同时,在这些同分异构体中,U-Oyl键键长有随着Oyl-U-Oyl键角减小而增长的趋势。特别是当m>2时,“V”型铀酰结构配合物的U-Oyl键比线型铀酰结构配合物的U-Oyl键长约大0.2 Å (图1)。然而,在同分异构体中U-OH键长随角度的变化可以忽略不计。此外,U-Oyl键长随着OH‒配体数的增加而增长:铀酰基团上每增加一个OH‒配体,线型Oyl-U-Oyl结构中的U-Oyl键长增长0.02~0.05 Å;在相同条件下,“V”型Oyl-U-Oyl结构中的U-Oyl键长增加了0.05~0.10 Å。对于U-OH键,无论配合物中铀酰结构是线型的还是“V”型的,每增加一个OH‒配体后,U-OH键长增加约0.10 Å。由此可以看出,铀酰基团构型对U-Oyl键长的影响大于对U-OH键长的影响。
表 1 羟基-铀酰配合物中U-O键级以及Oyl-U-Oyl键的角度Table 1. Bond orders of U-O and bond angles of Oyl-U-Oyl in hydroxyl-uranyl complexes配合物 U-Oyl键级 U-OH键级 ∠Oyl-U-Oyl/(º) [UO2(OH)]+-A 2.220,2.220 1.667 158.5 UO2(OH)2-A 1.969,1.969 1.375,1.375 149.3 UO2(OH)2-B 2.057,2.057 1.319,1.319 180.0 [UO2(OH)3]‒-A 1.878,1.863 1.084~1.090 179.6 [UO2(OH)3]‒-B 1.174,1.189 1.146~1.156 39.8 [UO2(OH)4]2‒-A 1.753,1.753 0.847~0.883 171.7 [UO2(OH)4]2‒-B 0.979,0.993 0.952~0.994 38.3 2.2 氢键以及配体H2O对配合物结构的影响
从图1可知,当m=1、2时,H2O可以通过与铀原子成U-(OH)2键或与其他原子成氢键的形式分布在中心[UO2(OH)m]2−m基团周围。根据H2O配体与其他官能团之间相互作用的不同,水-羟基-铀酰配合物([UO2(OH)m(H2O)n]2−m)主要有以下几种类型:当m=1、2时,(1) H2O与铀酰基团直接成U-(OH)2键,形成[UO2(OH)m(H2O)n]2−m配合物;(2) H2O配体与OH‒配体和/或铀酰基团中的氧原子之间形成氢键,形成[UO2(OH)m]2−m•nH2O配合物;(3)当n=2时,其中一个H2O配体直接与中心[UO2(OH)m]2−m基团成键,另一个H2O配体以氢键的形式分布在中心基团周围,形成[UO2(OH)m(H2O)]2−m•H2O配合物。当m=3、4时,H2O配体只以氢键的形式分布在中心基团周围,形成[UO2(OH)m]2−m•nH2O配合物。总之,铀酰基的OH‒和H2O配体越多,同分异构体的数目也越多。根据H2O配体与其它原子成键方式的不同,这些氢键可以分为以下几种类型:(1) H2O配体只与一个OH‒作用,形成H2O···HO氢键,表示为H1;(2) H2O配体与OH‒配体以及铀原子作用,形成氢键HO···H2O-U(H2);(3)当一个H2O配体与一个OH‒配体和铀酰基团中的一个氧原子作用时,可以形成两个相互连接的氢键,OH···OH2···Oyl或HO···HOH···Oyl(H3a或H3b);(4)一个H2O配体与两个OH‒配体作用,形成HO···HOH···OH氢键(H4)。此外,当H2O配体数为2时,H2O配体之间可以相互作用形成分子间氢键,而其中的一个H2O配体与其他原子作用形成其它新键;(5)另一个H2O配体与铀原子作用,形成U-OH···OH2氢键(H5);(6)一个H2O配体与一个OH‒配体作用,形成HO···HOH···HOH氢键(H6)。当m=1、2时,[UO2(OH)m(H2O)n]2−m配合物中氢键的结构是H1、H2、H3和H5;而当m=3、4时,配合物中的氢键结构是H3、H4和H6。而H5和H6的氢键仅分别存在于[UO2(OH)(H2O)]+-C和[UO2(OH)3-(H2O)2]‒-B中。由此可以推测,水分子倾向于同[UO2(OH)m]2−m配合物之间形成氢键,而不是在H2O分子之间形成氢键。此外,随着更多的OH‒和H2O配体的加入,形成了更多的氢键。这些不同氢键之间的连接使[UO2(OH)m(H2O)n]2−m配合物形成了笼状结构。
随着更多H2O配体通过氢键作用配位到羟基-铀酰团簇上,配合物的结构变得更加复杂,其氢键作用强弱不均。为了探究H2O配位数与氢键作用之间的关系,统计了[UO2(OH)m(H2O)n]2−m配合物的氢键中距离最近的O···O间距,结果列入表2。将配合物中的O···O间距与PBE1PBE/6-311+G**计算水平下二聚体水中的O···O间距(2.87 Å)相比,当m=1、2时,配合物中的O···O间距大多小于水二聚体中的O···O间距;而m=3时,配合物中的O···O间距大多超过水二聚体中的O···O间距。可见,氢键作用受到水配体数的影响:随着水配体数目的增加,氢键作用在减弱(同类型结构相比较)。
表 2 [UO2(OH)m(H2O)n]2−m配合物中氢键之间距离最近的O···O间距dO···OTable 2. Shortest O···O distances(dO···O) in hydrogen bonds of [UO2(OH)m(H2O)n]2−m配合物 dO···O/ Å 氢键类型 [UO2(OH)(H2O)]+-B 2.57 H1 [UO2(OH)(H2O)2]+-B 2.61 H1 [UO2(OH)(H2O)2]+-C 2.54 H5 UO2(OH)2(H2O)-A 2.80 H1 UO2(OH)2(H2O)-B 2.77,2.90 H3a UO2(OH)2(H2O)-C 2.72 H2 UO2(OH)2(H2O)2-A 2.82,2.82 H1 UO2(OH)2(H2O)2-B 2.77,2.91 H3a UO2(OH)2(H2O)2-C 2.84 H1 UO2(OH)2(H2O)2-D 2.72~2.90 H2,H3a UO2(OH)2(H2O)2-E 2.62 H2 UO2(OH)2(H2O)2-F 2.82,2.91 H3a [UO2(OH)3(H2O)]−-A 2.78,3.17 H3a [UO2(OH)3(H2O)]−-B 2.74,3.17 H3b [UO2(OH)3(H2O)]−-C 2.94,2.94 H4 [UO2(OH)3(H2O)2]−-A 2.75~3.19 H3a,H3b [UO2(OH)3(H2O)2]−B 2.66~2.99 H3a,H6 [UO2(OH)3(H2O)2]−-C 2.87~3.00 H4 [UO2(OH)3(H2O)2]−-D 2.63~2.95 H4,H3b [UO2(OH)4(H2O)]2−-A 2.76,2.77 H4 [UO2(OH)4(H2O)]2−-B 2.65,3.07 H3b [UO2(OH)4(H2O)]2−-C 2.77,2.79 H4 [UO2(OH)4(H2O)2]2−-A 2.66~3.08 H3b [UO2(OH)4(H2O)2]2−-B 2.80,2.81 H4 [UO2(OH)4(H2O)2]2−-C 2.67~3.06 H4,H3b [UO2(OH)4(H2O)2]2−-D 2.78,2.83 H4 [UO2(OH)4(H2O)2]2−-E 2.61~2.91 H4, Oyl-HOH-Oyl H2O配体除了对配合物有稳定作用外,还影响其几何结构。对于羟基配体数相同的[UO2(OH)m-(H2O)n]2−m配合物,随着H2O配体数的增加,U-Oyl键长也在逐渐增长。尤其是当配合物中的铀酰结构是“V”型时,U-Oyl键长的增加趋势更明显。对于U-OH键,当水分子与中心基团[UO2(OH)m]2−m形成氢键时,U-OH键长可能随着水配体数的增加而增长,也可能在减短。例如,U-OH键长从[UO2(OH)]+-A中的2.038 Å减少到了[UO2(OH)(H2O)]+-B中的2.019 Å,而U-OH键长从[UO2(OH)4]2−-A中的2.344 Å增长到了[UO2(OH)4(H2O)]2−-A中的2.371 Å(图1)。但是随着OH‒配体数的增加,U-OH键长在逐渐增加,每增加一个OH−配体,U-OH键长增加0.06~0.25 Å;当m = 3时,这种增长幅度在达到峰值后开始下降。当H2O通过U-OH2键与铀酰基团结合时,U-OH键长只随H2O配体数的增加而增长,但增加幅度不超过0.02 Å (每增加一个H2O配体)。综上所述,H2O配体对U-OH键长的直接影响较小,但是H2O与其他原子形成氢键后间接地促进了OH‒配体数对U-OH键长的影响。
2.3 [UO2(OH)m(H2O)n]2−m配合物的能量与稳定性
[UO2(OH)m(H2O)n]2−m同分异构体的能量列入表3和表4。在这些同分异构体中,具有“V”型铀酰结构的配合物(m>2)的能量比线型铀酰结构的配合物的能量约低259 kJ/mol。对于直线型铀酰结构的UO2(OH)2配合物,UO2(OH)2-B(Oyl-U-Oyl角度为180º)的能量比UO2(OH)2-A(Oyl-U-Oyl角度约为158º)的能量约高 87.6 kJ/mol。由此可见,当m>2时配合物稳定性随Oyl-U-Oyl角度减少而增加。当m = 1、2时,H2O配体可以通过U-OH2键或以氢键形式与[UO2(OH)m]2−m形成[UO2(OH)m(H2O)n]2−m配合物。由表3可知:以U-OH2键作用形成的[UO2(OH)(H2O)]+配合物的能量比以氢键作用形成的[UO2(OH)]+•H2O配合物的能量约低142 kJ/mol。进一步比较后发现,[UO2(OH)m]2‒m•nH2O/[UO2(OH)m(H2O)]2‒m•(n‒1)H2O配合物与[UO2(OH)m(H2O)n]2‒m(m=1、2; n=1、2)配合物之间的能量差值随着OH‒配体数的增加而减小。说明U-OH2键作用力与氢键作用力之间的差异也在减小。随着这种趋势的增加,当OH‒配体数达到一定数目时,氢键作用力会高于U-OH2键作用力。这就可以说明为什么m=3、4时配合物中没有出现U-OH2键。另一方面,随着H2O配体的增加配合物变得更加稳定。氢键因为具有较强的吸引力和导向性可以对邻近配体进行定向作用[18],因此在加入更多的水配体后,配合物变得更稳定;不同的氢键异构体,能量差较小,不超过25 kJ/mol。
表 3 线型铀酰结构配合物的总能量ETable 3. Total energies(E) of uranyl complexes in linear configurations配合物 E/a.u. 氢键(H)或者U-OH2键 [UO2(OH)]+-A ‒ 263.249979 [UO2(OH)(H2O)]+-A ‒ 339.688705 U-OH2 [UO2(OH)(H2O)]+-B ‒ 339.634548 H1 [UO2(OH)(H2O)2]+-A ‒ 416.118039 U-OH2 [UO2(OH)(H2O)2]+-B ‒ 416.085962 U-OH2, H1 [UO2(OH)(H2O)2]+-C ‒ 416.094641 H5 UO2(OH)2-A ‒ 339.350029 UO2(OH)2-B ‒ 339.316667 UO2(OH)2(H2O)-A ‒ 415.732603 H3a UO2(OH)2(H2O)-B ‒ 415.733388 H1 UO2(OH)2(H2O)-C ‒ 415.753052 U-OH2 UO2(OH)2(H2O)-D ‒ 415.749504 H2 UO2(OH)2(H2O)2-A ‒ 492.114309 H1 UO2(OH)2(H2O)2-B ‒ 492.116423 H3a UO2(OH)2(H2O)2-C ‒ 492.133596 U-OH2, H1 UO2(OH)2(H2O)2-D ‒ 492.132080 H2, H3a UO2(OH)2(H2O)2-E ‒ 492.150444 U-OH2, H2 UO2(OH)2(H2O)2-F ‒ 492.135820 U-OH2, H3a [UO2(OH)3]−-A ‒ 415.228615 [UO2(OH)3(H2O)]−-A ‒ 491.618247 H3a [UO2(OH)3(H2O)]−-B ‒ 491.626276 H3b [UO2(OH)3(H2O)2]−-A ‒ 568.014355 H3a, H3b [UO2(OH)3(H2O)2]−-B ‒ 568.023401 H3a, H6 [UO2(OH)4]2−-A ‒ 490.919837 [UO2(OH)4(H2O)]2−-A ‒ 567.336951 H4 [UO2(OH)4(H2O)]2−-B ‒ 567.335458 H3b [UO2(OH)4(H2O)2]2‒-A ‒ 643.746227 H3b [UO2(OH)4(H2O)2]2‒-B ‒ 643.751694 H4 表 4 “V”型(Oyl-U-Oyl)铀酰结构的配合物的总能量ETable 4. Total energies(E) of uranyl complexes in “V”(Oyl-U-Oyl) configurations配合物 E/a.u. 氢键(H)或者 U-OH2 键 [UO2(OH)3]‒-B ‒ 415.330359 [UO2(OH)3(H2O)]‒-C ‒ 491.725732 H4 [UO2(OH)3(H2O)2]‒-C ‒ 568.119679 H4 [UO2(OH)3(H2O)2]‒-D ‒ 568.124436 H4, H3b [UO2(OH)4]2‒-B ‒ 491.033735 [UO2(OH)4(H2O)]2‒-C ‒ 567.450171 H4 [UO2(OH)4(H2O)2]2‒-C ‒ 643.860042 H4, H3b [UO2(OH)4(H2O)2]2‒-D ‒ 643.864711 H4 [UO2(OH)4(H2O)2]2‒-E ‒ 643.861227 H4, H3b 2.4 配合物形成的热力学函数
[UO2(OH)m(H2O)n]2−m配合物的形成路径分两种。一是OH‒配体与铀原子配合形成[UO2(OH)m]2−m配合物,二是H2O配体配位到[UO2(OH)m]2−m中形成[UO2(OH)m(H2O)n]2−m配合物。每增加一个OH‒配体或一个H2O配体到配合物中的反应如式(1)、(2)。
\mathrm{\left[UO_{\mathrm{2}}\mathrm{(OH)}_{(\mathit{m}-1)}\right]^{3-\mathit{m}}+OH}^{\mathrm{-}}\to[\mathrm{UO}_{\mathrm{2}}\mathrm{(OH)}_m]^{2-m} (1) \begin{split}&[\mathrm{UO}_{ \mathrm{2}} \mathrm{(OH)}_{ {m}} \mathrm{(H}_{ \mathrm{2}} \mathrm{O)}_{ {(n-1)}} ]^{2-m}\mathrm{+H}_{ \mathrm{2}} \mathrm{O}\to\\&\qquad\quad [{{\mathrm{UO}}}_{ \mathrm{2}} \mathrm{(OH)}_{ {m}} \mathrm{(H}_{ \mathrm{2}} \mathrm{O)}_{ {n}} ]^{2-m} \end{split} (2) 上述反应的结合能、焓变和吉布斯自由能变(ΔE、ΔH和ΔG)计算如式(3)—(5)。
\Delta E=E_{m/n}-E_{(m-1/\left(n-1\right)}-E_{\mathrm{OH^-}\mathrm{/H_2O}} (3) \mathrm{\Delta}\mathit{H}\mathrm{=}\mathit{H}_{m/n}-\mathit{H}_{(m-1/\left(n-1\right)}-\mathit{H}_{\mathrm{OH^{\mathrm{-}}}\mathrm{/H_2O}} (4) \mathrm{\Delta}\mathit{G}\mathrm{=}\mathit{G}_{m/n}-\mathit{G}_{(m-1/\left(n-1\right)}-\mathit{G}_{\mathrm{OH}^{\mathrm{-}}\mathrm{/H_2O}} (5) 由ΔG = ΔH – TΔS可得TΔS值,生成[UO2(OH)m]2‒m配合物的反应和配合物中每增加一个H2O配体时的热力学函数值分别列入表5和表6。由表5可知:对于[UO2(OH)m]2−m配合物,铀酰基团与OH‒配体之间的相互作用力较强;但随着OH‒配体数的增加,作用力强度在逐渐减弱;尤其当m≤3时,反应(1)的ΔG值明显小于零,表明OH‒配体与铀酰基团之间的相互作用力很强;当m=4时,ΔG值则有不同的变化。由线型和“V”型[UO2(OH)3]‒生成线型[UO2(OH)4]2‒配合物的ΔG值分别为157.79 kJ/mol和430.10 kJ/mol;而由“V”型和线型[UO2(OH)3]‒生成“V”型 [UO2(OH)4]2‒配合物的ΔG值分别是135.50 kJ/mol和–136.81 kJ/mol。表明羟基配位数由3增加到4时,唯一可自发的反应是[UO2(OH)3]‒(线型铀酰结构)+ OH‒→[UO2(OH)4]2‒(“V”型铀酰结构,即表5中的[UO2(OH)4]2‒-B);即当OH‒配体的配位数大于3时,有形成“V”型铀酰结构配合物的趋势。由表6可知,当m=1时,H2O配体与铀酰基团间的U-OH2键作用力很强。此外,水分子还可以与[UO2(OH)m]2‒m间形成氢键。当m=2、3时,水分子与[UO2(OH)m]2‒m之间形成的氢键作用力较弱,甚至在m=2时氢键作用力微乎其微;而当m=4时,氢键作用力开始明显增强,这也与之前的结论一致。所以,OH‒配体数间接地影响着H2O配体与[UO2(OH)m]2‒m基团之间的氢键作用力:当OH‒配体数为1时,H2O配体与[UO2(OH)m]2‒m基团之间不仅直接形成强配位键,同时还有较强的氢键作用力。这是因为随着OH‒配体数增加至4时,[UO2(OH)m]2‒m中氢键受体的负电荷增大,促进H2O与[UO2(OH)m]2‒m氢键作用。表明利用氢氧化钠溶液可从有机相中捕获U(Ⅵ)配合物,实现铀元素的回收和再利用[2-3, 18]。表6中的ΔG值表明大多数H2O配位到[UO2(OH)m]2‒m的过程在热力学上可行。
表 5 每配位一个OH‒时配合物的结合能(ΔE,含零点能校正)、焓变(ΔH)、吉布斯自由能变(ΔG)及TΔS值Table 5. Binding energies(ΔE with ZPE corrections), enthalpy changes(ΔH), changes of Gibbs free energies(ΔG) and TΔS values for each coordinated OH‒产物 ΔE/
(kJ•mol–1)ΔH/
(kJ•mol–1)ΔG/
(kJ•mol–1)TΔS/
(kJ•mol–1)[UO2(OH)]+-A ‒ 1622.37 ‒ 1627.25 ‒ 1591.29 ‒35.96 UO2(OH)2-A ‒948.37 ‒950.28 ‒914.71 ‒35.57 UO2(OH)2-B ‒859.46 ‒864.10 ‒819.23 ‒44.87 [UO2(OH)3]‒-A ‒367.50 ‒369.71 ‒331.40 ‒38.31 [UO2(OH)3]‒-B ‒635.21 ‒635.75 ‒603.71 ‒32.04 [UO2(OH)4]2‒-A1) 123.91 122.06 157.79 ‒35.73 [UO2(OH)4]2‒-A1) 391.63 388.10 430.10 ‒42.00 [UO2(OH)4]2‒-B2) 98.79 93.25 135.50 ‒42.25 [UO2(OH)4]2‒-B2) ‒168.93 ‒172.79 ‒136.81 ‒35.98 注:1) 分别表示由线型和“V”型[UO2(OH)3]‒生成的线型[UO2(OH)4]2‒
配合物;
2) 分别表示由“V”型和线型[UO2(OH)3]‒生成的“V”型
[UO2(OH)4]2‒配合物
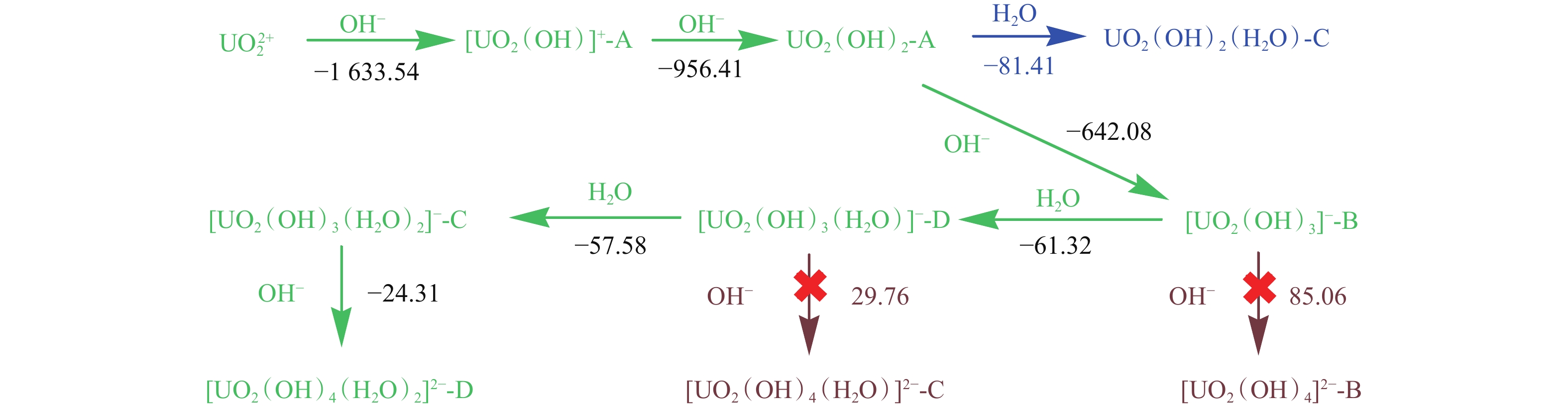
3) T=298.15 K表 6 每增加一个H2O时配合物的结合能、焓变、吉布斯自由能变及TΔS值Table 6. Binding energies(ΔE with ZPE corrections), enthalpy changes(ΔH), changes of Gibbs free energies(ΔG) and TΔS values for each coordinated H2O产物 ΔE/(kJ•mol‒1) ΔH/(kJ•mol‒1) ΔG/(kJ•mol‒1) TΔS/(kJ•mol-1) [UO2(OH)(H2O)]+-A ‒165.72 ‒168.18 ‒130.44 ‒37.74 [UO2(OH)(H2O)]+-B ‒24.97 ‒26.03 1.08 ‒27.11 [UO2(OH)(H2O)2]+-A ‒141.57 ‒143.56 ‒105.61 ‒37.95 [UO2(OH)(H2O)2]+-B ‒59.00 ‒59.64 ‒28.97 ‒30.67 [UO2(OH)(H2O)2]+-C ‒222.89 ‒225.83 ‒181.33 ‒44.50 UO2(OH)2(H2O)-A ‒19.91 ‒20.28 7.11 ‒27.39 UO2(OH)2(H2O)-B ‒19.72 ‒22.47 16.01 ‒38.48 UO2(OH)2(H2O)-C ‒73.89 ‒74.97 ‒40.25 ‒34.72 UO2(OH)2(H2O)-D ‒62.04 ‒64.72 ‒24.89 ‒39.84 UO2(OH)2(H2O)2-A ‒17.30 ‒17.82 9.39 ‒27.22 UO2(OH)2(H2O)2-B ‒19.11 ‒21.74 16.23 ‒37.97 UO2(OH)2(H2O)2-C ‒14.97 ‒17.44 16.47 ‒33.91 UO2(OH)2(H2O)2-D ‒18.32 ‒20.64 16.97 ‒37.61 UO2(OH)2(H2O)2-E ‒56.31 ‒59.34 ‒17.50 ‒41.84 UO2(OH)2(H2O)2-F ‒18.36 ‒20.96 17.56 ‒38.52 [UO2(OH)3(H2O)]‒-A ‒37.91 ‒39.59 ‒4.70 ‒34.89 [UO2(OH)3(H2O)]‒-B ‒57.98 ‒60.01 ‒24.82 ‒35.19 [UO2(OH)3(H2O)]‒-C ‒48.71 ‒52.63 ‒12.89 ‒39.74 [UO2(OH)3(H2O)2]‒-A ‒34.09 ‒35.49 ‒0.88 ‒34.61 [UO2(OH)3(H2O)2]‒-B ‒51.82 ‒57.61 ‒6.77 ‒50.84 [UO2(OH)3(H2O)2]‒-C ‒45.90 ‒49.37 ‒9.10 ‒40.27 [UO2(OH)3(H2O)2]‒-D ‒58.52 ‒62.73 ‒18.00 ‒44.74 [UO2(OH)4(H2O)]2‒-A ‒107.24 ‒110.37 85.81 ‒196.18 [UO2(OH)4(H2O)]2‒-B ‒104.27 ‒108.34 ‒64.63 ‒43.71 [UO2(OH)4(H2O)]2‒-C ‒102.76 ‒106.45 ‒67.81 ‒38.63 [UO2(OH)4(H2O)2]2‒-A ‒91.19 ‒94.55 ‒53.50 ‒41.05 [UO2(OH)4(H2O)2]2‒-B ‒98.21 ‒102.99 ‒216.68 113.69 [UO2(OH)4(H2O)2]2‒-C ‒89.80 ‒92.86 ‒52.92 ‒39.94 [UO2(OH)4(H2O)2]2‒-D ‒101.17 ‒104.14 ‒52.92 ‒51.22 [UO2(OH)4(H2O)2]2‒-E ‒95.08 ‒97.07 ‒62.68 ‒34.38 注:T=298.15 K;ΔE,经零点能校正 为了比较[UO2(OH)m(H2O)n]2‒m配合物之间相互转化时的能量变化规律,计算了OH‒和H2O单一配体分别形成最稳定[UO2(OH)m]2‒m和[UO2(H2O)n]2+时的逐级形成能,结果列入表7。应当指出两种单一配体的最高配位数均为5,与文献[14]中{\mathrm{UO}}_2^{2+} 配合物的最高配位数6不一致;其原因在于单一OH‒配体较大的排斥力,而单一H2O的配位作用较弱(弱场配体)。由表7可知,逐级生成 [UO2(OH)m]2‒m配合物时,开始释放出大量的能量,但是随着OH‒配位数增加,释放的能量急剧减少,直至吸收能量。而逐级生成 [UO2(H2O)n]2+配合物时,持续释放出少量能量,且随着H2O配位数增加,释放的能量略有减少。结合上述两种配体的逐级生成能特征,可将[UO2(OH)m(H2O)n]2‒m的形成过程分为两步:首先是OH‒配位到铀酰基团上,然后是溶液中的水分子与[UO2(OH)m]2‒m间形成U-OH2键或者氢键,再根据[UO2(OH)m-(H2O)n]2‒m配合物的形成路径来研究反应过程中的能量释放。对同分异构体,主要讨论其最稳定构型的能量变化。由前面的讨论可以得出,在[UO2(OH)m(H2O)n]2‒m的同分异构体中,当m=1、2时,具有线型Oyl-U-Oyl结构和U-OH2键的配合物能量最低;当m= 3、4时,具有“V”型Oyl-U-Oyl结构和氢键的配合物能量最低。为了进一步验证“V”型配合物的稳定性,在MP2水平下,用文中相同的组合基组,优化[UO2(OH)3]‒结构,其“V”型配合物比酰氧原子在轴向上的羟基配合物能量低131.46 kJ/mol。当水分子开始配位到[UO2(OH)m]2−m上时,伴随着少量能量的释放;当n=1~2时,释放的能量随H2O数量增加而略有降低;当m=1~3时,OH‒配位到中心铀酰基团上会放出热量,两者之间的作用力也很强;当m=4时,反应过程中开始吸收热量,导致OH‒配体与铀酰基团间的作用力减弱。H2O的逐级配位始终释放能量,且OH‒配体对其影响不大。逐级配位过程的能量变化及反应路径如图2所示。
表 7 最低能量线型与“V”型铀酰结构配合物逐级形成过程中释放的能量ΔETable 7. Released energies(ΔE) of lowest lying linear and “V” type uranyl complexes in stepwise coordination process逐级配位反应 ΔE/(kJ•mol‒1) {\mathrm{UO}}_2^{2+} +OH−→[UO2(OH)]+-A ‒ 1633.54 [UO2(OH)]+-A+OH−→UO2(OH)2-A ‒956.41 UO2(OH)2-A+OH− →[UO2(OH)3]−-B ‒642.08 [UO2(OH)3]−-B+OH−→[UO2(OH)4]2−-B 85.06 [UO2(OH)4]2−-B+OH−→[UO2(OH)5]3− 471.05 {\mathrm{UO}}_2^{2+} +H2O→[UO2(H2O)]2+ ‒298.92 [UO2(H2O)]2++H2O→[UO2(H2O)2]2+ ‒262.88 [UO2(H2O)2]2++H2O→[UO2(H2O)3]2+ ‒229.53 [UO2(H2O)3]2++ H2O→[UO2(H2O)4]2+ ‒177.53 [UO2(H2O)4]2++ H2O→[UO2(H2O)5]2+ ‒121.42 [UO2(OH)]+-A+H2O →[UO2(OH)(H2O)]+-A ‒175.15 [UO2(OH)(H2O)]+-A+H2O→[UO2(OH)(H2O)2]+-A ‒150.49 UO2(OH)2-A+H2O→UO2(OH)2(H2O)-C ‒81.41 UO2(OH)2(H2O)-C+H2O→UO2(OH)2(H2O)2-E ‒66.62 [UO2(OH)3]−-B+H2O→[UO2(OH)3(H2O)]−-D ‒61.32 [UO2(OH)3(H2O)]−-B+H2O→[UO2(OH)3(H2O)2]−-C ‒65.92 [UO2(OH)4]2−-B+H2O→[UO2(OH)4( H2O)]2−-C ‒116.62 [UO2(OH)4( H2O)]2−-C+H2O→[UO2(OH)4(H2O)2]2−-D ‒111.66 注:ΔE未经零点能校正;当羟基配位数为3和4时为“V”型结构 3. 结 论
用DFT方法计算了[UO2(OH)m(H2O)n]2−m配合物的结构与形成过程。得到以下结论:
(1)按Oyl-U-Oyl角度的不同,铀酰基团有两种不同的构型:线型结构与“V”型结构,当m=1~2时,配合物中的铀酰基团可以是线型Oyl-U-Oyl结构,也可以是“V”型Oyl-U-Oyl结构;而m = 3~4时,仅存在“V”型Oyl-U-Oyl结构;
(2)对于分子式相同的配合物,其中的铀酰基团中的U-Oyl键长随着Oyl-U-Oyl角度的减小而增长,OH‒通过与铀酰基团上的铀原子配位形成[UO2(OH)m]2−m;随着更多的OH‒和H2O配体配位到铀酰基团上,这些配合物的结构变得更加立体,最后趋于笼状结构;
(3)当m=1、2时,具有线型Oyl-U-Oyl结构的配合物更稳定;m=3、4时,具有“V”型 Oyl-U-Oyl结构的配合物更稳定;当m < 4时,所有生成[UO2(OH)m]2‒m配合物的反应在热力学上都是可行的;而生成[UO2(OH)4]2‒配合物的唯一自发反应是线型铀酰配合物 [UO2(OH)3]‒与OH‒生成“V”型[UO2(OH)4]2‒配合物。
(4) {\mathrm{UO}}_2^{2+} 同OH‒和H2O进行逐级配位时,起始阶段放热量大,之后释放的能量开始减少,释放的能量又因OH‒与H2O配位到铀酰基团上而有差别:当OH‒配体数达到一定数目时,反应释放的能量开始减少甚至开始吸收能量;而H2O配体数增加时,则近似持续释放能量。
上述[UO2(OH)m(H2O)n]2−m配合物的特征,对碱性溶液中的铀酰基离子活性、溶解度和离子交换等过程产生重要影响。OH‒与H2O配位和竞争,影响溶液中离子的相对浓度和分布。研究结果为解释和控制铀酰基离子的化学反应和溶液行为提供理论依据。
-
表 1 羟基-铀酰配合物中U-O键级以及Oyl-U-Oyl键的角度
Table 1 Bond orders of U-O and bond angles of Oyl-U-Oyl in hydroxyl-uranyl complexes
配合物 U-Oyl键级 U-OH键级 ∠Oyl-U-Oyl/(º) [UO2(OH)]+-A 2.220,2.220 1.667 158.5 UO2(OH)2-A 1.969,1.969 1.375,1.375 149.3 UO2(OH)2-B 2.057,2.057 1.319,1.319 180.0 [UO2(OH)3]‒-A 1.878,1.863 1.084~1.090 179.6 [UO2(OH)3]‒-B 1.174,1.189 1.146~1.156 39.8 [UO2(OH)4]2‒-A 1.753,1.753 0.847~0.883 171.7 [UO2(OH)4]2‒-B 0.979,0.993 0.952~0.994 38.3 表 2 [UO2(OH)m(H2O)n]2−m配合物中氢键之间距离最近的O···O间距dO···O
Table 2 Shortest O···O distances(dO···O) in hydrogen bonds of [UO2(OH)m(H2O)n]2−m
配合物 dO···O/ Å 氢键类型 [UO2(OH)(H2O)]+-B 2.57 H1 [UO2(OH)(H2O)2]+-B 2.61 H1 [UO2(OH)(H2O)2]+-C 2.54 H5 UO2(OH)2(H2O)-A 2.80 H1 UO2(OH)2(H2O)-B 2.77,2.90 H3a UO2(OH)2(H2O)-C 2.72 H2 UO2(OH)2(H2O)2-A 2.82,2.82 H1 UO2(OH)2(H2O)2-B 2.77,2.91 H3a UO2(OH)2(H2O)2-C 2.84 H1 UO2(OH)2(H2O)2-D 2.72~2.90 H2,H3a UO2(OH)2(H2O)2-E 2.62 H2 UO2(OH)2(H2O)2-F 2.82,2.91 H3a [UO2(OH)3(H2O)]−-A 2.78,3.17 H3a [UO2(OH)3(H2O)]−-B 2.74,3.17 H3b [UO2(OH)3(H2O)]−-C 2.94,2.94 H4 [UO2(OH)3(H2O)2]−-A 2.75~3.19 H3a,H3b [UO2(OH)3(H2O)2]−B 2.66~2.99 H3a,H6 [UO2(OH)3(H2O)2]−-C 2.87~3.00 H4 [UO2(OH)3(H2O)2]−-D 2.63~2.95 H4,H3b [UO2(OH)4(H2O)]2−-A 2.76,2.77 H4 [UO2(OH)4(H2O)]2−-B 2.65,3.07 H3b [UO2(OH)4(H2O)]2−-C 2.77,2.79 H4 [UO2(OH)4(H2O)2]2−-A 2.66~3.08 H3b [UO2(OH)4(H2O)2]2−-B 2.80,2.81 H4 [UO2(OH)4(H2O)2]2−-C 2.67~3.06 H4,H3b [UO2(OH)4(H2O)2]2−-D 2.78,2.83 H4 [UO2(OH)4(H2O)2]2−-E 2.61~2.91 H4, Oyl-HOH-Oyl 表 3 线型铀酰结构配合物的总能量E
Table 3 Total energies(E) of uranyl complexes in linear configurations
配合物 E/a.u. 氢键(H)或者U-OH2键 [UO2(OH)]+-A ‒ 263.249979 [UO2(OH)(H2O)]+-A ‒ 339.688705 U-OH2 [UO2(OH)(H2O)]+-B ‒ 339.634548 H1 [UO2(OH)(H2O)2]+-A ‒ 416.118039 U-OH2 [UO2(OH)(H2O)2]+-B ‒ 416.085962 U-OH2, H1 [UO2(OH)(H2O)2]+-C ‒ 416.094641 H5 UO2(OH)2-A ‒ 339.350029 UO2(OH)2-B ‒ 339.316667 UO2(OH)2(H2O)-A ‒ 415.732603 H3a UO2(OH)2(H2O)-B ‒ 415.733388 H1 UO2(OH)2(H2O)-C ‒ 415.753052 U-OH2 UO2(OH)2(H2O)-D ‒ 415.749504 H2 UO2(OH)2(H2O)2-A ‒ 492.114309 H1 UO2(OH)2(H2O)2-B ‒ 492.116423 H3a UO2(OH)2(H2O)2-C ‒ 492.133596 U-OH2, H1 UO2(OH)2(H2O)2-D ‒ 492.132080 H2, H3a UO2(OH)2(H2O)2-E ‒ 492.150444 U-OH2, H2 UO2(OH)2(H2O)2-F ‒ 492.135820 U-OH2, H3a [UO2(OH)3]−-A ‒ 415.228615 [UO2(OH)3(H2O)]−-A ‒ 491.618247 H3a [UO2(OH)3(H2O)]−-B ‒ 491.626276 H3b [UO2(OH)3(H2O)2]−-A ‒ 568.014355 H3a, H3b [UO2(OH)3(H2O)2]−-B ‒ 568.023401 H3a, H6 [UO2(OH)4]2−-A ‒ 490.919837 [UO2(OH)4(H2O)]2−-A ‒ 567.336951 H4 [UO2(OH)4(H2O)]2−-B ‒ 567.335458 H3b [UO2(OH)4(H2O)2]2‒-A ‒ 643.746227 H3b [UO2(OH)4(H2O)2]2‒-B ‒ 643.751694 H4 表 4 “V”型(Oyl-U-Oyl)铀酰结构的配合物的总能量E
Table 4 Total energies(E) of uranyl complexes in “V”(Oyl-U-Oyl) configurations
配合物 E/a.u. 氢键(H)或者 U-OH2 键 [UO2(OH)3]‒-B ‒ 415.330359 [UO2(OH)3(H2O)]‒-C ‒ 491.725732 H4 [UO2(OH)3(H2O)2]‒-C ‒ 568.119679 H4 [UO2(OH)3(H2O)2]‒-D ‒ 568.124436 H4, H3b [UO2(OH)4]2‒-B ‒ 491.033735 [UO2(OH)4(H2O)]2‒-C ‒ 567.450171 H4 [UO2(OH)4(H2O)2]2‒-C ‒ 643.860042 H4, H3b [UO2(OH)4(H2O)2]2‒-D ‒ 643.864711 H4 [UO2(OH)4(H2O)2]2‒-E ‒ 643.861227 H4, H3b 表 5 每配位一个OH‒时配合物的结合能(ΔE,含零点能校正)、焓变(ΔH)、吉布斯自由能变(ΔG)及TΔS值
Table 5 Binding energies(ΔE with ZPE corrections), enthalpy changes(ΔH), changes of Gibbs free energies(ΔG) and TΔS values for each coordinated OH‒
产物 ΔE/
(kJ•mol–1)ΔH/
(kJ•mol–1)ΔG/
(kJ•mol–1)TΔS/
(kJ•mol–1)[UO2(OH)]+-A ‒ 1622.37 ‒ 1627.25 ‒ 1591.29 ‒35.96 UO2(OH)2-A ‒948.37 ‒950.28 ‒914.71 ‒35.57 UO2(OH)2-B ‒859.46 ‒864.10 ‒819.23 ‒44.87 [UO2(OH)3]‒-A ‒367.50 ‒369.71 ‒331.40 ‒38.31 [UO2(OH)3]‒-B ‒635.21 ‒635.75 ‒603.71 ‒32.04 [UO2(OH)4]2‒-A1) 123.91 122.06 157.79 ‒35.73 [UO2(OH)4]2‒-A1) 391.63 388.10 430.10 ‒42.00 [UO2(OH)4]2‒-B2) 98.79 93.25 135.50 ‒42.25 [UO2(OH)4]2‒-B2) ‒168.93 ‒172.79 ‒136.81 ‒35.98 注:1) 分别表示由线型和“V”型[UO2(OH)3]‒生成的线型[UO2(OH)4]2‒
配合物;
2) 分别表示由“V”型和线型[UO2(OH)3]‒生成的“V”型
[UO2(OH)4]2‒配合物
3) T=298.15 K表 6 每增加一个H2O时配合物的结合能、焓变、吉布斯自由能变及TΔS值
Table 6 Binding energies(ΔE with ZPE corrections), enthalpy changes(ΔH), changes of Gibbs free energies(ΔG) and TΔS values for each coordinated H2O
产物 ΔE/(kJ•mol‒1) ΔH/(kJ•mol‒1) ΔG/(kJ•mol‒1) TΔS/(kJ•mol-1) [UO2(OH)(H2O)]+-A ‒165.72 ‒168.18 ‒130.44 ‒37.74 [UO2(OH)(H2O)]+-B ‒24.97 ‒26.03 1.08 ‒27.11 [UO2(OH)(H2O)2]+-A ‒141.57 ‒143.56 ‒105.61 ‒37.95 [UO2(OH)(H2O)2]+-B ‒59.00 ‒59.64 ‒28.97 ‒30.67 [UO2(OH)(H2O)2]+-C ‒222.89 ‒225.83 ‒181.33 ‒44.50 UO2(OH)2(H2O)-A ‒19.91 ‒20.28 7.11 ‒27.39 UO2(OH)2(H2O)-B ‒19.72 ‒22.47 16.01 ‒38.48 UO2(OH)2(H2O)-C ‒73.89 ‒74.97 ‒40.25 ‒34.72 UO2(OH)2(H2O)-D ‒62.04 ‒64.72 ‒24.89 ‒39.84 UO2(OH)2(H2O)2-A ‒17.30 ‒17.82 9.39 ‒27.22 UO2(OH)2(H2O)2-B ‒19.11 ‒21.74 16.23 ‒37.97 UO2(OH)2(H2O)2-C ‒14.97 ‒17.44 16.47 ‒33.91 UO2(OH)2(H2O)2-D ‒18.32 ‒20.64 16.97 ‒37.61 UO2(OH)2(H2O)2-E ‒56.31 ‒59.34 ‒17.50 ‒41.84 UO2(OH)2(H2O)2-F ‒18.36 ‒20.96 17.56 ‒38.52 [UO2(OH)3(H2O)]‒-A ‒37.91 ‒39.59 ‒4.70 ‒34.89 [UO2(OH)3(H2O)]‒-B ‒57.98 ‒60.01 ‒24.82 ‒35.19 [UO2(OH)3(H2O)]‒-C ‒48.71 ‒52.63 ‒12.89 ‒39.74 [UO2(OH)3(H2O)2]‒-A ‒34.09 ‒35.49 ‒0.88 ‒34.61 [UO2(OH)3(H2O)2]‒-B ‒51.82 ‒57.61 ‒6.77 ‒50.84 [UO2(OH)3(H2O)2]‒-C ‒45.90 ‒49.37 ‒9.10 ‒40.27 [UO2(OH)3(H2O)2]‒-D ‒58.52 ‒62.73 ‒18.00 ‒44.74 [UO2(OH)4(H2O)]2‒-A ‒107.24 ‒110.37 85.81 ‒196.18 [UO2(OH)4(H2O)]2‒-B ‒104.27 ‒108.34 ‒64.63 ‒43.71 [UO2(OH)4(H2O)]2‒-C ‒102.76 ‒106.45 ‒67.81 ‒38.63 [UO2(OH)4(H2O)2]2‒-A ‒91.19 ‒94.55 ‒53.50 ‒41.05 [UO2(OH)4(H2O)2]2‒-B ‒98.21 ‒102.99 ‒216.68 113.69 [UO2(OH)4(H2O)2]2‒-C ‒89.80 ‒92.86 ‒52.92 ‒39.94 [UO2(OH)4(H2O)2]2‒-D ‒101.17 ‒104.14 ‒52.92 ‒51.22 [UO2(OH)4(H2O)2]2‒-E ‒95.08 ‒97.07 ‒62.68 ‒34.38 注:T=298.15 K;ΔE,经零点能校正 表 7 最低能量线型与“V”型铀酰结构配合物逐级形成过程中释放的能量ΔE
Table 7 Released energies(ΔE) of lowest lying linear and “V” type uranyl complexes in stepwise coordination process
逐级配位反应 ΔE/(kJ•mol‒1) {\mathrm{UO}}_2^{2+} +OH−→[UO2(OH)]+-A ‒ 1633.54 [UO2(OH)]+-A+OH−→UO2(OH)2-A ‒956.41 UO2(OH)2-A+OH− →[UO2(OH)3]−-B ‒642.08 [UO2(OH)3]−-B+OH−→[UO2(OH)4]2−-B 85.06 [UO2(OH)4]2−-B+OH−→[UO2(OH)5]3− 471.05 {\mathrm{UO}}_2^{2+} +H2O→[UO2(H2O)]2+ ‒298.92 [UO2(H2O)]2++H2O→[UO2(H2O)2]2+ ‒262.88 [UO2(H2O)2]2++H2O→[UO2(H2O)3]2+ ‒229.53 [UO2(H2O)3]2++ H2O→[UO2(H2O)4]2+ ‒177.53 [UO2(H2O)4]2++ H2O→[UO2(H2O)5]2+ ‒121.42 [UO2(OH)]+-A+H2O →[UO2(OH)(H2O)]+-A ‒175.15 [UO2(OH)(H2O)]+-A+H2O→[UO2(OH)(H2O)2]+-A ‒150.49 UO2(OH)2-A+H2O→UO2(OH)2(H2O)-C ‒81.41 UO2(OH)2(H2O)-C+H2O→UO2(OH)2(H2O)2-E ‒66.62 [UO2(OH)3]−-B+H2O→[UO2(OH)3(H2O)]−-D ‒61.32 [UO2(OH)3(H2O)]−-B+H2O→[UO2(OH)3(H2O)2]−-C ‒65.92 [UO2(OH)4]2−-B+H2O→[UO2(OH)4( H2O)]2−-C ‒116.62 [UO2(OH)4( H2O)]2−-C+H2O→[UO2(OH)4(H2O)2]2−-D ‒111.66 注:ΔE未经零点能校正;当羟基配位数为3和4时为“V”型结构 -
[1] 王聪,王凯,胡淑贤.铀酰大环配体化合物的理论研究进展[J].核化学与放射化学,2023,45(5):377-388. doi: 10.7538/hhx.2023.45.05.0377 [2] Gordon P L, O’Dell C, Watkin J G. Synthesis and energetic content of red oil[J]. J Hazard Mater, 1994, 39(1): 87-105. doi: 10.1016/0304-3894(94)00061-1
[3] Gordon P L, O’Dell C, Watkin J G. Investigation of red oil decomposition by simulated Hanford tank wastes[J]. J Hazard Mater, 1994, 39(1): 69-86. doi: 10.1016/0304-3894(94)00060-3
[4] Zinkle S J, Was G S. Materials challenges in nuclear energy[J]. Acta Mater, 2013, 61(3): 735-758. doi: 10.1016/j.actamat.2012.11.004
[5] 郑智阳,廖磊,董益捷,等.金属有机骨架基材料从水溶液中吸附U(Ⅵ)的研究进展[J].湿法冶金,2020,39(5):361-365. [6] Mishra S, Soda A K, Sridhar M, et al. Identification of diluent degradation products in radiolyzed PUREX solvent[J]. Solvent Extr Ion Exch, 2018, 36(1): 54-65. doi: 10.1080/07366299.2017.1417776
[7] Peper S M, Brodnax L F, Field S E, et al. Kinetic study of the oxidative dissolution of UO2 in aqueous carbonate media[J]. Ind Eng Chem Res, 2004, 43(26): 8188-8193. doi: 10.1021/ie049457y
[8] Sun Q, Jiang L, Gong L, et al. Experimental study on thermal hazard of tributyl phosphate-nitric acid mixtures using micro calorimeter technique[J]. J Hazard Mater, 2016, 314: 230-236. doi: 10.1016/j.jhazmat.2016.04.030
[9] Schurhammer R, Wipff G. Effect of the TBP and water on the complexation of uranyl nitrate and the dissolution of nitric acid into supercritical CO2: a theoretical study[J]. J Phys Chem A, 2005, 109(23): 5208-5216. doi: 10.1021/jp051029y
[10] Wai C M, Liao Y J, Liao W, et al. Uranium dioxide in ionic liquid with a tri-n-butylphosphate-HNO3 complex: dissolution and coordination environment[J]. Dalton Trans, 2011, 40(18): 5039. doi: 10.1039/c0dt01518k
[11] Ruipérez F, Danilo C, Réal F, et al. An ab initio theoretical study of the electronic structure of {{\mathrm{UO}}_2^{+}} and [UO2(CO3)3]5–[J]. J Phys Chem A, 2009, 113(8): 1420-1428. doi: 10.1021/jp809108h
[12] 于涛,曾凯,徐玲玲,等.电喷雾质谱法鉴别铀矿渣浸取液中乙酸铀酰形态[J].分析化学,2023,51(10):1678-1684. [13] 吴思远,陈亚雯,郭宁,等.北山地下水中三元铀酰配合物的化学种态分析[J].核化学与放射化学,2024,46(5):499-505. [14] Reta D, Ortu F, Randall S, et al. The performance of density functional theory for the description of ground and excited state properties of inorganic and organometallic uranium compounds[J]. J Organomet Chem, 2018, 857: 58-74. doi: 10.1016/j.jorganchem.2017.09.021
[15] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, revision A. 01[CP]. Wallingford, United States: Gaussian Inc, 2009.
[16] Lu T, Chen F. Multiwfn: a multifunctional wavefunction analyzer[J]. J Comput Chem, 2012, 33(5): 580-592. doi: 10.1002/jcc.22885
[17] Hratchian H P, Sonnenberg J L, Hay P J, et al. Theoretical investigation of uranyl dihydroxide: oxo ligand exchange, water catalysis, and vibrational spectra[J]. J Phys Chem A, 2005, 109(38): 8579-8586. doi: 10.1021/jp052616m
[18] Trofimov T, Samsonov M, Lee S, et al. Ultrasound enhancement of dissolution kinetics of uranium oxides in supercritical carbon dioxide[J]. J Chem Technol Biotechnol, 2001, 76(12): 1223-1226. doi: 10.1002/jctb.509





 下载:
下载: